Nomenclatura de alquenos
La IUPAC nombra los alquenos cambiando la terminación -ano del alcano por -eno. Se elige como cadena principal la más larga que contenga el doble enlace y se numera para que tome el localizador más bajo.
Los alquenos presentan isomería cis/trans. En alquenos tri y tetrasustituidos se utiliza la notación Z/E.
Los alquenos presentan isomería cis/trans. En alquenos tri y tetrasustituidos se utiliza la notación Z/E.
Estructura del doble enlace
Los alquenos son planos con carbonos de hibridación sp2. El doble enlace está formado por un enlace σ que se consigue por solapamiento de híbridos sp2 y un enlace π que se logra por solapamiento del par de orbitales p perpendiculares al plano de la molécula.
Estabilidad del doble enlace
Los dobles enlaces se estabilizan por hiperconjugación, de modo que un alqueno es tanto más estable cuantos más sustituyentes partan de los carbonos sp2.
Síntesis de alquenos
Los alquenos se obtienen mediante reacciones de eliminación a partir de haloalcanos y mediante deshidratación de alcoholes.
Reacciones de alquenos
Los alquenos adicionan gran variedad de reactivos al doble enlace. Así, reaccionan con los ácidos de los halógenos, agua en medio ácido.(1)
La isomería cis-trans no se limita a los alquenos disustituidos. Puede presentarse en cualquier alqueno que tenga los dos carbonos del doble enlace fijos a dos grupos distintos. Sin embargo, si uno de los carbonos del doble enlace está fijo a dos grupos idénticos, no es posible que haya isomería cis-trans.
Los alquenos cis son menos estables que sus isómeros trans, debido a la tensión estérica (espacial) entre los dos sustituyentes voluminosos del mismo lado del doble enlace.

Los dobles enlaces se acomodan a anillos de todos los tamaños. El cicloalqueno más sencillo, el ciclopropeno fue sintetizado por primera vez en 1922.
El ciclopropano está desestabilizado por la tensión angular debido a que su ángulo de enlace es de 60º, mucho menor que el ángulo que corresponde a un carbono con hibridación sp3. El ciclopropeno está todavía más tensionado, ya que la desviación respecto al ángulo de enlace de los carbonos doblemente enlazados con una hibridación sp2 de 120º es todavía mayor. El ciclobuteno tiene, por supuesto, menor tensión angular que el ciclopropeno, y la tensión angular del ciclopenteno, ciclohexeno y cicloalquenos superiores es despreciable.(2)
Síntesis
Los alquenos se pueden sintetizar mediante las siguientes reacciones:
- Por cambio de grupo funcional
- Deshidrohalogenación
- CH3CH2Br + KOH → CH2=CH2 + H2O + KBr
- Deshidratación
- La eliminación de agua a partir de alcoholes, por ejemplo:
- CH3CH2OH + H2SO4 → CH3CH2OSO3H + H2O → H2C=CH2 + H2SO4 + H2O
- También por la reacción de Chugaev y la reacción de Grieco.
- Deshalogenación
- BrCH2CH2Br + Zn → CH2=CH2 + ZnBr2
- Pirólisis (con calor)
- CH3(CH2)4 → CH2=CH2 + CH3CH2CH2CH3
- Por formación de enlaces carbono-carbono
- Por reacciones de acoplamiento con metales:
- Reacción de Heck
- Reacción de Suzuki
- Acoplamiento de Hiyama
- Acoplamiento de Stille (3)
- Adición electrófilica
- La reacción característica de los alquenos es la adición de sustancias al doble enlace, según la ecuación:
 La primera etapa de la reacción es la adición del protón al alqueno nucleófilo, para formar el carbocatión. En la segunda etapa, el carbocatión reacciona con el nucleófilo.La adición de electrófilos a alquenos hace posible la síntesis de muchas clases de compuestos:
La primera etapa de la reacción es la adición del protón al alqueno nucleófilo, para formar el carbocatión. En la segunda etapa, el carbocatión reacciona con el nucleófilo.La adición de electrófilos a alquenos hace posible la síntesis de muchas clases de compuestos:

- Halogenuros de alquilo, alcoholes, alcanos, dioles, eteres pueden ser sintetizados a partir de alquenos por reacciones de sustitución electrófila. El producto obtenido depende solamente del electrófilo y del nucleófilo usado en la reacción.(4)
- Polimerización de alquenos
- Los alquenos, en presencia de ácido sulfurico concentrado, condensan formado cadenas llamadas polímeros. Veamos un ejemplo con el 2-Metilpropeno:
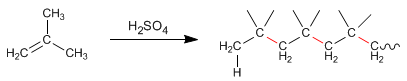 Etapa 1. Protonación del doble enlace para formar el catión tert-butilo
Etapa 1. Protonación del doble enlace para formar el catión tert-butilo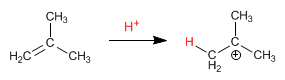 Etapa 2. Ataque nucleófilo del alqueno al carbocatión formado.
Etapa 2. Ataque nucleófilo del alqueno al carbocatión formado.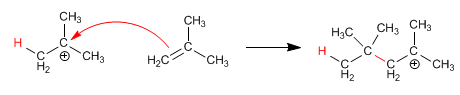 Etapa 3. El catión formado en la etapa anterior vuelve a ser atacado por otra molécula de alqueno, formándose el polímero.
Etapa 3. El catión formado en la etapa anterior vuelve a ser atacado por otra molécula de alqueno, formándose el polímero.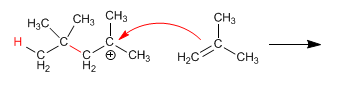 Debido a que este tipo de polimerización transcurre con formación de carbocationes, recibe el nombre de polimerización catiónica.El eteno no puede polimerizar vía carbocatión (forma carbocationes inestables), pero se puede obtener polietileno calentando etileno a elevadas presiones y en presencia de peróxidos. En este caso la polimerización sigue un mecanismo radicalario y se denomina polimerización por radicales libres.
Debido a que este tipo de polimerización transcurre con formación de carbocationes, recibe el nombre de polimerización catiónica.El eteno no puede polimerizar vía carbocatión (forma carbocationes inestables), pero se puede obtener polietileno calentando etileno a elevadas presiones y en presencia de peróxidos. En este caso la polimerización sigue un mecanismo radicalario y se denomina polimerización por radicales libres.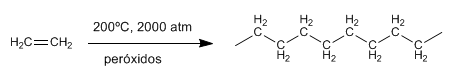 (5)
(5) - Bibliografía1.- http://www.quimicaorganica.net/alquenos.html
- 2.- http://rabfis15.uco.es/weiqo/Tutorial_weiqo/Hoja14a1a2P1.html
- 3.- http://es.wikipedia.org/wiki/Alqueno
- 4.- http://www.quimicaorganica.org/alquenos-reacciones-teoria/index.php
- 5.- http://www.quimicaorganica.org/alquenos-reacciones-teoria/polimerizacion-alquenos-cationica-radicalaria.html

No hay comentarios:
Publicar un comentario