Nomenclatura de alcoholes
Se nombran sustituyendo la terminación de los alcanos -ano por -ol. Se toma como cadena principal la más larga que contenga el grupo hidroxilo y se numera otorgándole el localizador más bajo.
Acidez y basicidad de los alcoholes
Los alcoholes son ácidos, el hidrógeno del grupo -OH tiene un pKa de 16.
Propiedades físicas
Los puntos de fusión y ebullición son elevados debido a la formación de puentes de hidrógeno.
Síntesis de alcoholes
Se obtienen mediante sustitución nucleófila y por reducción de aldehídos y cetonas. El ataque de reactivos organometálicos a electrófilos -carbonilos, epoxidos, esteres- es un método importante en la síntesis de alcoholes.
Obtención de haloalcanos a partir de alcoholes
Los alcoholes se transforman en haloalcanos por reacción con PBr3. El mecanismo es del tipo SN2 y requiere alcoholes primarios o secundarios.
Oxidación de alcoholes
El trióxido de cromo oxida alcoholes primarios a ácidos carboxílicos y alcoholes secundarios a cetonas. También se pueden emplear otros oxidantes como el permanganato de potasio o el dicromato de potasio.
Formación de alcóxidos
Las bases fuertes los desprotonan formando los alcóxidos.
Propiedades Físicas
enlazantes. La electronegatividad del oxígeno provoca la polarización del enlace O-H y del C-O, lo que produce la aparición de momentos dipolares.
Los puntos de fusión y ebullición son elevados debido a la formación de puentes de hidrogeno. Estos enlaces se forman entre el oxígeno de una molécula y el hidrógeno de otra.(1)
Alcoholes primarios, secundarios y terciarios
Un alcohol es primario, si el átomo de hidrogeno (H) sustituido por el grupo oxidrilo (-OH) pertenece a un carbón (C) primario:
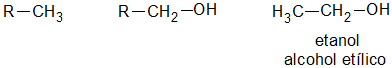
es secundario, si el átomo de hidrogeno (H) sustituido por el grupo oxidrilo (-OH) pertenece a un carbón (C) secundario:
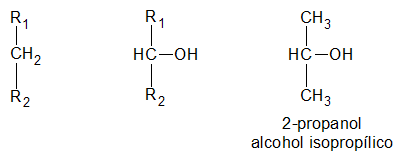
y finalmente, es terciario, si el átomo de hidrogeno (H) sustituido por el grupo oxidrilo (-OH) pertenece a un carbón (C) terciario:
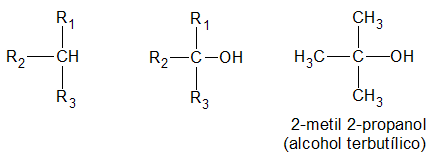
La función alcohol puede repetirse en la misma molécula, resultando monoles, o alcoholes monovalentes; dioles, o alcoholes bivalentes; trioles, o alcoholes trivalentes, etc.
| Fórmula | Nombre | Clasificación |
|---|---|---|
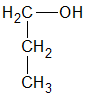 | 1-propanol | monol |
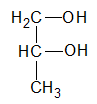 | 1,2-propanodiol (propilen glicol) | diol |
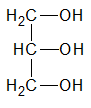 | 1,2,3-propanotriol (glicerina) | triol |
Ensayos de solubilidad
Técnica. Se añaden 10 ml de alcohol etílico de 95 % a 10 ml de agua contenidos en un tubo de ensayos. Se satura la solución con carbonato de potasio y se observa el resultado. Des pues se determina, aproximadamente, la cantidad en peso de alcohol n-butílico, alcohol sec-butílico y alcohol ter-butílico que pueden disolverse en 5 ml de agua, anotándose todas las observaciones y resultados.
Observaciones
Alcohol | Solubilidad en agua |
METANOL | EN TODAS PROPORCIONES |
ETANOL | EN TODAS PROPORCIONES |
BUTANOL | 8,3 % |
OCTANOL | PRACTICAMENTE INSOLUBLE |
Alcohol | Solubilidad en agua |
n-butílico | 9,1 % |
t-butílico | miscible |
iso-butílico | 10,0 % |
Alcohol | Solubilidad en agua |
Etanol + carbonato de sodio | Insoluble |
Interpretación
Los alcoholes de pocos átomos de carbono son solubles en todas las proporciones. La solubilidad del alcohol reside en el grupo -OH incorporado a la molécula del alcano respectivo.
Las uniones puente de hidrógeno también se manifiestan entre las moléculas de agua y el alcohol
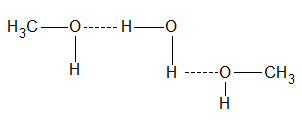
Esta asociación explica la solubilidad del alcohol metílico y etílico con el agua: forman semicombinaciones.
La solubilidad de los alcoholes disminuye con el aumento del número de átomos de carbono, pues el grupo hidroxilo constituye una parte cada vez más pequeña de la molécula y el parecido con el agua disminuye a la par que aumenta la semejanza con el hidrocarburo respectivo.
A partir del exanol (incluido) son prácticamente insolubles. Los miembros superiores de la serie son solamente solubles en solventes polares.
Se puede explicar de una manera similar la causa de insolubilidad en presencia de carbonato: la posibilidad de formar uniones puente de hidrógeno disminuye y con ello la solubilidad. El carbonato impide que se efectivicen estas fuerzas de unión.
Se pueden disolver cantidades apreciables de compuestos iónicos como el cloruro de sodio con alcoholes inferiores. Se dice que el grupo hidroxilo es hidrofílico, lo cual signifixa amigo del agua, debido a su afinidad por esta y otras sustancias polares.
Al grupo alquilo del alcohol se le llama hidrofóbico, lo cual significa que odia el agua porque funciona como un alcano: rompe la red de atracciones dipolo-dipolo y los puentes de hidrógeno de un solvente polar como el agua. El grupo alquilo hace que el alcohol sea menos hidrofílico, pero confiere solubilidad en solventes orgánicos no polares. Muchos alcoholes son miscibles con una gran variedad de solventes no polares.
Un grupo alquilo de cuatro carbonos es lo suficientemente grande para que algunos de sus isómeros no sean solubles en agua, aunque, el alcohol t-butílico, con su forma esférica compacta, es miscible.
Como los alcanos no reaccionan con los metales alcalinos, debe admitirse que el átomo reemplazado es el de hidrógeno unido al hidroxilo, lo que prueba la polarización de la molécula de los alcoholes.
La reacción de los alcoholes con los metales alcalinos es menos enérgica que la de éstos con el agua.
La acidez de los alcoholes varía ampliamente, desde los alcoholes que son casi tan ácidos como el agua. hasta algunos que son mucho menos ácidos. La constante de disociación ácida, Ka, de un alcohol, queda definida por el equilibrio siguiente:
Los alcoholes más ácidos, como el etanol y el metanol, reaccionan rápidamente con sodio para formar metóxido y etóxido de sodio. Los alcoholes secundarios, como el 2-butanol, reaccionan con velocidad más moderada. Los alcoholes terciarios, como el alcohol t-butílico, reaccionan lentamente. Con los alcoholes terciarios con frecuencia se usa el potasio, K, porque es más reactivo que el sodio y la reacción puede completarse en un tiempo razonable.
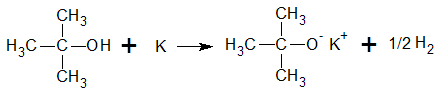
Reacciones por sustitución del grupo hidroxilo. Formación de ésteres inorgánicos.
CUANDO SE EFECTÚA LA REACCIÓN ENTRE UN ALCOHOL Y UN ÁCIDO INORGÁNICO SE PRODUCE UN ÉSTER INORGÁNICO.
En estos casos el agua se forma entre el -OH del alcohol y el protón del ácido
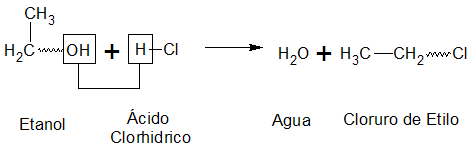 (2)
(2)Las principales diferencias entre alcoholes y fenoles son:
- Por oxidación, los fenoles forman productos coloreados, complejos de composición indefinida. Los alcoholes oxidados suavemente forman aldehídos y cetonas.
- Los fenoles reaccionan con el ácido nítrico (HNO3), dando derivados nitrados, los alcoholes, en cambio, forman ésteres (3)PoliolesLos polioles son alcoholes polihídricos con varios grupos hidroxilo. La fórmula química general es CnH2n+2On. Un poliol es un carbohidrato que contiene más grupos hidroxilo que el azúcar al cual está asociado. Por ejemplo, si un grupo hidroxilo remplaza al grupo cetona de una cetosa o al grupo aldehído de una aldosa se obtiene un alcohol de azúcar. Así de la manosa se obtiene manitol, de la glucosa se obtiene glucitol (conocido como sorbitol), de la galactosa se obtiene galactitol (conocido como dulcitol),
Los polioles pueden clasificarse en alditoles y inositoles o ciclitoles.
Los alditoles tienen una cadena linear de átomos de carbono. También se les conoce como polioles alifáticos. Los inositoles o ciclitoles tienen una cadena cíclica de átomos de carbono.
Los alditoles son alcoholes polihídricos alifáticos. Los alditoles, también considerados como alcoholes azúcares, se obtienen cuando el grupo aldehído o cetona de un azúcar es reducucido en grupo alcohol. Por lo menos 19 alditoles existen naturalmente en las plantas. Los más comunes en la naturaleza son: el sorbitol, el manitol y el galactitol
Los inositoles o ciclitoles son derivados del ciclohexano en los cuales un hidrógeno de cada carbono ha sido reemplazado por un grupo hidroxilo. (5)EnolesFormación de enoles y enolatosLos aldehídos y cetonas tienen hidrógenos ácidos en el carbono α, que se pueden sustraer empleando bases fuertes, formándose los iones enolato estabilizados por resonancia.
Alquilación de los iones enolato
Los iones enolato se alquilan por ataque a electrófilos carbonados como pueden ser haloalcanos, epóxidos, otros carbonilos, etc.
Halogenación de aldehídos y cetonas
La posición α de aldehídos y cetonas se halogena a través de intermedios de tipo enol o enolato.
Condensación aldólica
Los aldehídos y cetonas dan lugar a condensaciones catalizadas por bases en las que el enolato de una molécula ataca al carbonilo de otra. Esta reacción se conoce como condensación aldólica.
Michael y Robinson
Los enolatos también atacan a carbonilos α,β-insaturados, formando compuestos 1,5-dicarbonílicos que en etapas posteriores pueden condensar mediante una aldólica intramolecular. Son las denominadas reacciones de Michael y Robinson. (4)
Bibliografía
1.- http://www.quimicaorganica.net/alcoholes.html
2.- http://www.textoscientificos.com/quimica/alcoholes
3.- http://fenolesfd.blogspot.com/2008/11/diferencia-entre-alcoholes-y-fenoles.html
4.- http://www.quimicaorganica.net/enoles-enolatos.html
5.- http://es.wikipedia.org/wiki/Poliol
No hay comentarios:
Publicar un comentario