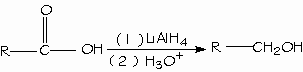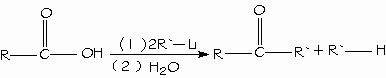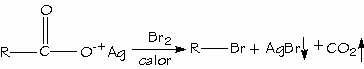ALDEHIDOS Y CETONAS
El grupo funcional característico de los aldehidos y cetonas es el grupo carbonilo. Para los aldehidos, el carbono carbonilo siempre es un carbono terminal y se encuentra enlazado a un hidrógeno, mientras que en las cetonas nunca será un carbono terminal ya que debe estar enlazado a otros dos átomos de carbono.
La fórmula general condensada para un aldehido se abrevia como R – CHO y la de una cetona como R – CO – R’.
Para nombrar los aldehidos, la “o” final del nombre del alcano respectivo se sustituye por el sufijo “al”. Para los miembros inferiores de la familia predomina el empleo de los nombres comunes como por ejemplo, Metanal o formaldehido, HCHO; etanal o acetaldehido, CH3 – CHO; propanal o propionaldehido, CH3 – CH2 – CHO; butanal o butiraldehido, CH3 – CH2 – CH2 – CHO; ventanal o valeraldehido, CH3 – CH2 – CH2 – CH2 - CHO y benzaldehido, C6H5 - CHO.
Para nombrar las cetonas, la “o” final del nombre del alcano respectivo se sustituye por el sufijo “ona”. La acetona es la misma la propanona o dimetilcetona, CH3 – CO – CH3; y la butanona es denominada también metiletilcetona, CH3 – CO – CH2 - CH3. La 2-pentanona, CH3 – CO – CH2 – CH2 - CH3 y la 3-pentanona, CH3 – CH2 – CO – CH2 - CH3 son isómeros de posición. La metilfenilcetona o acetofenona y la difenilcetona o benzofenona son cetonas aromáticas porque alguno de los radicales hidrocarbonados enlazados al grupo
carbonilo son grupos arilos.
PROPIEDADES FISICAS DE ALDEHIDOS Y CETONAS
Salvo el formaldehído que es un gas, casi todos los aldehídos son líquidos. Los miembros inferiores son de olor agradable, muchos otros se emplean en la fabricación de perfumes y sabores artificiales. El formaldehído y el acetaldehído son infinitamente solubles en agua, los homólogos superiores no son hidrosolubles. Los aldehídos son menos densos que el agua e incoloros. Las cetonas tienen propiedades casi idénticas a los aldehídos y se diferencian de estos por su suave olor.
PROPIEDADES QUIMICAS DE LOS ALDEHIDOS Y CETONAS
Las reacciones químicas de los aldehídos y cetonas son función del grupo carbonilo. Por su mayor electronegatividad, el oxígeno atrae el par electrónico mas hacia él alejándolo del carbono. En consecuencia, la distribución electrónica del enlace no resulta simétrica; el oxígeno es ligeramente negativo y el carbono ligeramente positivo. El grupo carbonilo puede representarse como dos formas resonantes, una neutra y otra con doble carga de la siguiente manera
Al examinar los productos que se forman cuando los reactivos se adicionan al doble enlace carbono – oxígeno, el fragmento positivo del reactivo siempre se adiciona al oxígeno y el fragmento negativo se une al carbono
REACCIONES DE ADICION NUCLEOFILA
La reacción global tanto para aldehídos como para cetonas es:
Introducción a la Bioquímica
C
O
C
O
+ H - X
H
X
Esta reacción permite a los aldehídos y cetonas adicionar agua para formar hidratos, ácido cianhídrico para formar cianhidrinas, alcoholes para formar hemiacetales o hemicetales y bisulfito de sodio, entre otros.
Mecanismo de adición nucleófila
La parte nucleófila del reactivo choca con el carbono carbonilo, rompe el enlace pi desplazándose los electrones hacia el oxígeno y originándose un intermediario bipolar de la siguiente manera
Adición de alcohol a aldehídos y cetonas
La adición de un mol de un alcohol a un aldehido o cetona produce un hemiacetal o hemicetal, respectivamente. Estos son productos inestables. Sin embargo, las estructuras cíclicas de los monosacáridos se configuran mediante un enlace hemiacetálico o hemicetálico interno entre el grupo aldehido y un grupo hidroxilo de la molécula. El hemiacetal formado entre acetaldehído y alcohol etílico y el hemicetal que resulta entre acetona y alcohol etílico tienen las siguientes fórmulas
CH3 - CH
OH
OCH2 - CH3
CH3 - C - CH3
OH
OCH2 - CH3
Hemiacetal Hemicetal
Los hemiacetales y hemicetales, en presencia de catalizadores ácidos reaccionan con una molécula de alcohol para formar acetales y cetales. El acetal formado entre acetaldehído y alcohol etílico y el cetal que resulta de la adición entre acetona y alcohol etílico tienen las siguientes fórmulas
CH3 - CH
OCH2 - CH3
CH3 - C - CH3
OCH2 - CH3
OCH2 - CH3 OCH2 - CH3
Acetal Cetal
Adición de cianuro de hidrógeno
La adición de ácido cianhídrico a un aldehído o cetona produce cianhidrina. Estas cianhidrinas son intermediarios importantes en la preparación de hidroxiácidos, aminoácidos y carbohidratos. Las cianhidrinas del acetaldehído y de la acetona tienen como fórmulas estructuras condensadas las siguientes
CH3 - CH
CN
CH3 - C - CH3
CN
OH OH
Cianhidrina del Acetaldehido Cianhidrina de la acetona
REACCIONES DE CONDENSACION CON DERIVADOS DEL AMONIACO
Los aldehídos y cetonas adicionan amoníaco y algunos compuestos derivados de forma NH2 – Y, y los productos obtenidos en un medio ácido, se deshidratan formando finalmente condensados en los que el carbono carbonilo se une doblemente con el nitrógeno del compuesto adicionado. Las reacciones escritas globalmente para aldehído y cetona son

Los compuestos que casi siempre se emplean en esta reacción son la hidroxilamina, NH2OH, semicarbazida, NH2–NH–CO–NH2, fenilhidracina, NH2–NH–C6H5, 2,4- dinitrofenilhidracina y las aminas primarias, NH2-R. Los productos de adición formados se denominan, respectivamente, oximas, semicarbazonas, fenilhidrazonas y bases de Schiff.
OXIDACIÓN DE ALDEHIDOS Y CETONAS
Los aldehídos oxidan fácilmente y se convierten en el ácido carboxílico respectivo, en contraste con las cetonas que son difíciles de oxidar, en presencia de los agentes oxidantes habituales de gran poder como el permanganato de potasio, dicromato de potasio y otros.
La reacción global de oxidación de un aldehído es la siguiente:

Al añadirle la mezcla oxidante a una cetona se comprueba que no hay oxidación por no cambiar el color. Esta propiedad permite diferenciar un aldehído de una cetona, mediante la utilización de oxidantes relativamente débiles, como soluciones alcalinas de compuestos cúpricos o argentosos que reciben el nombre de reactivos de Fehling, Benedict y Tollens
Reactivo de Fehling
El reactivo de Fehling permite determinar la presencia de aldehídos en una muestra desconocida. Se prepara de tal manera que es una mezcla de color azul que al añadirla a una muestra desconocida oxida a los grupos aldehídos y como resultado positivo de la prueba se observa un precipitado de color rojo ladrillo de óxido cuproso.
El reactivo de Fehling consta de dos soluciones A y B que se mezclan en partes iguales en el momento de usarse. La solución A es sulfato cúprico pentahidratado, mientras que la solución B es de tartrato sódio potásico e hidróxido de sodio en agua. Cuando se mezclan las dos soluciones, se obtiene un complejo cúprico tartárico en medio alcalino, de color
azul, de la siguiente manera:
El color azul de la solución cúprica del Fehling desaparece con la presencia de un precipitado de color rojo ladrillo (el cobre se reduce de +2 a +1) y la oxidación del aldehído al correspondiente ácido carboxílico
Reactivo de Benedict
La Prueba de Benedict tiene el mismo fundamento de la de Fehling y permite, por lo tanto, la determinación de aldehídos en una muestra desconocida. En este reactivo se emplea el citrato de sodio en reemplazo del tartrato sódico potásico y el complejo que se forma es de citrato sódico cúprico en un medio alcalino. La reacción de oxidación es la siguiente:
Reactivo de Tollens
Este reactivo contiene un ión complejo de plata amoniacal, que se reduce a plata metálica en presencia de aldehídos que son fácilmente oxidados. La plata se deposita y se observa como un espejo sobre las paredes del recipiente donde se realice la prueba. La reacción
general es:
H2 R - CHO NaNO O Ag(NH 3 3)2NO3 NaOH R - COONa NH3 2 + 3 + + 4 + 2 + 2 Ag + 2
Reactivo de Schiff
El reactivo de Schiff es clorhidrato de p-rosaanilina que se decolora con ácido sulfuroso y
reacciona con los aldehídos produciendo una coloración púrpura. Permite diferenciar aldehídos y cetonas
REDUCCION DE ALDEHIDOS Y CETONAS
Los aldehídos y cetonas se reducen con facilidad, a los correspondientes alcoholes primarios y secundarios, respectivamente. Pueden emplearse una gran variedad de agentes reductores, siendo el mas simple la mezcla de hidrógeno y metal
TAUTOMERIA CETO - ENOLICA
Los tautómeros son compuestos diferentes que normalmente se interconvierten a gran velocidad, pero que en principio se pueden aislar como compuestos separados y demostrar que su estructura es distinta. (En la práctica, tal separación se ha logrado en algunos casos).
En general, se escriben como dos formas estructurales en equilibrio de la siguiente manera:
Aldehido Enol
Cetona Enol
Reacción del Haloformo
El carácter ácido de los hidrógenos alfas se utiliza en la reacción del haloformo que es producida por las metilcetonas. Cuando tales compuestos se tratan con halógeno y base fuerte, se obtiene un compuesto trihalometano. Usando yodo como halógeno, el trihalometano formado es un precipitado amarillo de olor característico llamado yodoformo. Se conocen el cloroformo, bromoformo y yodoformo, de aquí el nombre de
haloformo
CH3 - CO - CH3 + 3 I 2+ 4 NaOH CH3 - COONa + CHI3 + 3 NaI + 3 H2 O
Aldolización
En presencia de bases, la mayoría de los aldehídos y cetonas se convierten en dímeros
llamados aldoles de la siguiente manera:
Aldehido Aldol
Cetona Aldol
Aldehídos y Cetonas importantes
El formaldehído es un gas incoloro y de olor extremadamente irritante. Se disuelve en agua en soluciones del 37 al 40 % (Formol). Es germicida, astringente, antiséptico y fungicida. La conservación de cadáveres con formaldehído depende mas de efecto antimicrobiano que el endurecimiento de los tejidos (se conjuga con las proteínas). El acetaldehído es un líquido incoloro, extremadamente volátil e importante en síntesis orgánica.
El cloral es el tricloroacetaldehído, aceite inestable y desagradable por lo cual se introdujo en medicina en forma de hidrato de cloral, CCl3 – CH(OH)2. Se utiliza en la síntesis del DDT y es el mas antiguo de los hipnóticos. Es muy irritante a la piel y a la mucosa. El paraldehido es un compuesto cíclico que se forma por la adición nucleofílica de tres moléculas de acetaldehído. Es un líquido incoloro, de aroma fuerte y sabor urente desagradable. Es un hipnótico de acción rápida. Es eficaz en convulsiones experimentales y se ha empleado en el tratamiento urgente del tétano, eclampsia, epilepsia y envenenamiento por medicamentos convulsionantes.
1.- http://galeon.hispavista.com/melaniocoronado/ALDEHIDOS.pdf