Configuracion electronica
Al referirnos a la configuración electrónica (o periódica) estamos hablando de la descripción de la ubicación de los electrones en los distintos niveles (con subniveles y orbitales) de un determinado átomo.
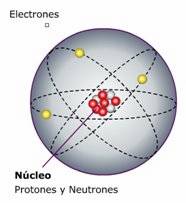 |
| Modelo atómico general. |
Configurar significa "ordenar" o "acomodar", y electrónico deriva de "electrón"; así, configuración electrónica es la manera ordenada de repartir los electrones en los niveles y subniveles de energía.
Científicamente, diremos que es la representación del modelo atómico de Schrödinger o modelo de la mecánica cuántica. En esta representación se indican los niveles, subniveles y los orbitales que ocupan los electrones.
Debemos acotar que aunque el modelo de Schrödinger es exacto sólo para el átomo de hidrógeno, para otros átomos es aplicable el mismo modelo mediante aproximaciones muy buenas.
Para comprender (visualizar o graficar) el mapa de configuración electrónica (o periódica) es necesario revisar los siguientes conceptos.
Los Números Cuánticos
En el contexto de la mecánica cuántica, en la descripción de un átomo se sustituye el concepto de órbita por el de orbital atómico. Un orbital atómico es la región del espacio alrededor del núcleo en el que la probabilidad de encontrar un electrón es máxima.
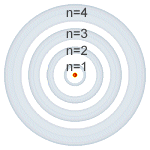 |
| Número cuántico principal (n). |
La solución matemática de la ecuación de Schrödinger precisa de tres números cuánticos. Cada trío de valores de estos números describe un orbital.
Número cuántico principal (n): puede tomar valores enteros (1, 2, 3, 4, 5, 6, 7) y coincide con el mismo número cuántico introducido por Bohr. Está relacionado con la distancia promedio del electrón al núcleo en un determinado orbital y, por tanto, con el tamaño de este e indica el nivel de energía.
Número cuántico secundario (l): puede tener todos los valores desde 0 hasta n – 1. Está relacionado con la forma del orbital e indica el subnivel de energía.
Número cuántico magnético (ml): puede tener todos los valores desde – l hasta + l pasando por cero. Describe la orientación espacial del orbital e indica el número de orbitales presentes en un subnivel determinado.
Para explicar determinadas características de los espectros de emisión se consideró que los electrones podían girar en torno a un eje propio, bien en el sentido de las agujas del reloj o en el sentido contrario. Para caracterizar esta doble posibilidad se introdujo el número cuántico de espín (ms) que toma los valores de + ½ o – ½..
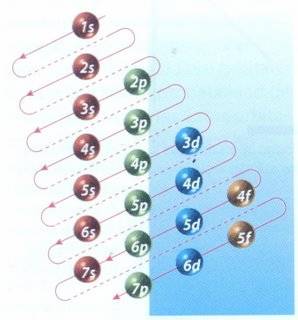 |
| Cuadro de las diagonales, mecanismo para distribuir electrones en sus diferentes niveles de energía.(1) |
Homolisis y heterolisis
Como ciencia, la química debe su existencia, por supuesto, al cambio químico: la conversión de una sustancia en otra. Moléculas antiguas son transformadas en otras nuevas, lo cual significa que deben romperse enlaces antiguos para generar otros nuevos; en su mayoría enlaces covalentes, en lo que respecta a la química orgánica.
Hemos visto que la ruptura de un enlace covalente puede ocurrir de dos maneras fundamentalmente diferentes, dependiendo de lo que suceda con los dos electrones que forman el par enlazante: en la homólisis, va un electrón a cada fragmento; en la heterólisis, van ambos electrones al mismo fragmento. Los sustantivos <<homólisis>> y heterólisis sólo se utilizan en su sentido literal, para indicar la ruptura de enlaces. No obstante, los adjetivos <<homolítico>> y <<heterolítico>> a falta de términos más adecuados se emplean en un sentido más general, para incluir también el proceso de la construcción de enlaces, pudiéndose definir así dos clases muy amplias de reacciones orgánicas.
Por consiguiente, las reacciones homolíticas son aquellas en las que se quitan o se proporcionan los electrones del par enlazante individualmente, tanto si se rompen enlaces,
 |
O si se rompen y forman simultáneamente,
Cada uno de los átomos que se separan lleva uno de los electrones enlazantes, y cada uno de los átomos que se juntan, proporciona uno de los electrones de enlace.
Reaccciones heterolíticas son aquellas en las cuales los electrones enlazantes se quitan o se proporcionan en pares. Tanto si se rompen enlaces.
 |
Uno de los átomos que se separa lleva ambos electrones de enlace, y uno de los átomos que se une proporciona el par.
.La química homolítica es, por tanto, la química del electrón impar, mientras que la química heterolítica es la del par de electrones. Mientras la primera se ocupa de partículas neutras, conocidas como radicales libes, la segunda tiene que ver con cargas positivas y negativas, es decir, con cationes y aniones. Las reacciones homolíticas suelen producirse en la fase gaseosa, o en disolventes cuya función principal se reduce a proporcionar un medio inerte que permita el movimiento libre de moléculas reaccionantes. Las reacciones heterolíticas se realizan generalmente en solución, y los disolventes tienen, como veremos, efectos muy poderosos; la magnitud de su poder está empezando a conocerse ahora.
Hasta aquí, la reacción que más nos ha venido ocupando la sustitución de radicales, ilustrada por la halogenación de los alcanos forma parte de la química homolítica.
Comencemos ahora el estudio de la química heterolítica. La mayor parte de la química orgánica es heterolítica, siendo ésta la que más trataremos en el resto del libro. Tal como sucede con la halogenación, la reacción con la que empezamos es una sustitución, pero de un tipo muy diferente: es heterolítica y del tipo específico llamado sustitución nucleofílica alifática.(2)
Hibridación
La hibridación es un fenómeno que consiste en la mezcla de orbítales atómicos puros para generar un conjunto de orbítales híbridos, los cuales tienen características combinadas de los orbítales originales.

La configuración electrónica desarrollada para el carbono es:

El primer paso en la hibridación, es la promoción de un electrón del orbital 2s al orbital 2p.

 |
Estos orbítales son idénticos entre si, pero diferentes de los originales ya que tienen características de los orbítales “s” y “p”.combinadas. Estos son los electrones que se comparten. En este tipo de hibridación se forman cuatro enlaces sencillos.

 |
El átomo de carbono forma un enlace doble y dos sencillos.
Hibridación sp
En este tipo de hibridación sólo se combina un orbital “p” con el orbital “s”.Con este tipo de hibridación el carbono puede formar un triple enlace.
Geometría molecular
El tipo de hibridación determina la geometría molecular la cual se resume en el siguiente cuadro.

 | Geometría molecular tetraédrica.- El carbono se encuentra en el centro de un tetraedro y los enlaces se dirigen hacia los vértices. |
 | Geometría triangular plana.- El carbono se encuentra en el centro de un triángulo. Se forma un doble enlace y dos enlaces sencillos. |
 | Geometría lineal.- Se forman dos enlaces sencillos y uno triple. |
En una cadena podemos identificar cuatro tipos de carbono, de acuerdo al número de carbonos al cual esté unido el átomo en cuestión.
PRIMARIO.- Está unido a un solo átomo de carbono. | Ejemplo: CH3-CH2-CH3 | |
Los carbonos de color rojo son primarios porque están unidos a un solo carbono, el de color azul. | ||
SECUNDARIO.- Está unido a dos átomos de carbono. | Ejemplo: CH3-CH2-CH3 | |
El carbono de color rojo es secundario porque está unido a dos átomos de carbono, los de color azul. | ||
TERCIARIO.- Está unidos a tres átomos de carbono. | Ejemplo:  | |
El carbono de color rojo es terciario porque está unido a tres carbonos, los de color azul. | ||
CUATERNARIO.- Está unido a 4 átomos de carbono. | Ejemplo:  | |
El carbono rojo es cuaternario porque está unido a 4 átomos de carbonos, los de color azul. | ||
Ejemplo 2.1
Complete los datos de la tabla de acuerdo a la siguiente estructura:

Carbono | Tipo de hibridación | Geometría molecular | Ángulo de enlace | Tipo de enlace | Tipo de carbono |
a) | Tetraédrica | 109.5° | Sencillo | Primario | |
b) | Tetraédrica | 109.5° | Sencillo | Cuaternario | |
c) | Triangular plana | 120° | Doble | Secundario | |
d) | Lineal | 180° | Triple | Primario | |
e) | Triangular plana | 120° | Doble | Secundario | |
f) | Lineal | 180° | Triple | Secundario |
Recuerde que para determinar el tipo de carbono se cuentan los carbonos unidos, no los enlaces. Como en el carbono d) está unido a un solo carbono (primario) y el otro enlace es con un átomo de cloro.(3)
En 1858, Kekulé demostró que el carbono es tetravalente y que sus átomos pueden unirse entre sí formando largas cadenas, lo que facilitó la comprensión de los compuestos orgánicos. Mención destacada merece también su descubrimiento de la estructura cíclica o anular de los compuestos aromáticos, como el benceno, de gran importancia en el posterior desarrollo de la síntesis de los colorantes.
Aun desconociendo la naturaleza del enlace químico propuso un ordenamiento, según la valencia de los átomos, en la estructura molecular de las sustancias. En lo esencial esta forma de representación en el plano de las fórmulas estructurales de las moléculas llega hasta nuestros días y permitió la estructuración de las familias orgánicas de acuerdo con la presencia de determinados grupos funcionales.
El problema de la explicación estructural de los isómeros ópticos debió esperar por la comprensión de la orientación espacial de los átomos en la estructura de las moléculas, y un primer paso en esta dirección fue dado por el químico holandés Jacobus Henricus van’t Hoff (1852–1911) al proponer la orientación tetraédrica de las valencias en el átomo de carbono, que da nacimiento a la estereoquímica como rama que se ocupa de definir la geometría molecular de las sustancias. Las investigaciones en el campo de los compuestos orgánicos debieron en una primera etapa al aislamiento y posterior caracterización de determinadas sustancias provenientes de materiales vegetales o animales. Berzelius, ante la complejidad observada por las sustancias orgánicas, desarrolla la teoría del vitalismo, según la cual los tejidos vivos debían disponer de una fuerza vital para la producción de las sustancias orgánicas. La extensión de estas nociones en el mundo académico de la época desalentó por un tiempo la investigación en el campo de la síntesis.
Pero ya en 1828 el pedagogo y químico alemán Friedrich Wöhler (1800–1882), sin proponérselo, descubre que el calentamiento de una sal (cianato amónico) producía la urea (un producto de excreción del metabolismo animal ya conocido por entonces), con lo cual el vitalismo recibe su primer golpe. No fue casual su aportación menos reconocida pero que aún hoy se aplica, al desarrollar el método de producir el acetileno a partir del carburo de calcio.
Debieron pasar varias décadas para que, primero A. W. Kolbe (1818–1884), discípulo de Wöhler, y luego Pierre E. M. Berthelot (1827–1907), lograran la síntesis de moléculas orgánicas simples (como el metanol, etanol y otras) a partir de las propias sustancias elementales de naturaleza inorgánica que los constituyen.(4)
Teoria Estructural de la Química Orgánica
Aun desconociendo la naturaleza del enlace químico propuso un ordenamiento, según la valencia de los átomos, en la estructura molecular de las sustancias. En lo esencial esta forma de representación en el plano de las fórmulas estructurales de las moléculas llega hasta nuestros días y permitió la estructuración de las familias orgánicas de acuerdo con la presencia de determinados grupos funcionales.
El problema de la explicación estructural de los isómeros ópticos debió esperar por la comprensión de la orientación espacial de los átomos en la estructura de las moléculas, y un primer paso en esta dirección fue dado por el químico holandés Jacobus Henricus van’t Hoff (1852–1911) al proponer la orientación tetraédrica de las valencias en el átomo de carbono, que da nacimiento a la estereoquímica como rama que se ocupa de definir la geometría molecular de las sustancias. Las investigaciones en el campo de los compuestos orgánicos debieron en una primera etapa al aislamiento y posterior caracterización de determinadas sustancias provenientes de materiales vegetales o animales. Berzelius, ante la complejidad observada por las sustancias orgánicas, desarrolla la teoría del vitalismo, según la cual los tejidos vivos debían disponer de una fuerza vital para la producción de las sustancias orgánicas. La extensión de estas nociones en el mundo académico de la época desalentó por un tiempo la investigación en el campo de la síntesis.
Pero ya en 1828 el pedagogo y químico alemán Friedrich Wöhler (1800–1882), sin proponérselo, descubre que el calentamiento de una sal (cianato amónico) producía la urea (un producto de excreción del metabolismo animal ya conocido por entonces), con lo cual el vitalismo recibe su primer golpe. No fue casual su aportación menos reconocida pero que aún hoy se aplica, al desarrollar el método de producir el acetileno a partir del carburo de calcio.
Debieron pasar varias décadas para que, primero A. W. Kolbe (1818–1884), discípulo de Wöhler, y luego Pierre E. M. Berthelot (1827–1907), lograran la síntesis de moléculas orgánicas simples (como el metanol, etanol y otras) a partir de las propias sustancias elementales de naturaleza inorgánica que los constituyen.(4)
Isómeros
Los isómeros son moléculas que tienen la misma fórmula molecular pero diferente estructura. Se clasifican en isómeros estructurales y estereoisómeros. Los isómeros estructurales difieren en la forma de unión de sus átomos y se clasifican en isómeros de cadena, posición y función. Como ejemplo, dibujemos los isómeros estructurales de fórmula C2H6O .

Solamente existen dos formas de unir los átomos que generan compuestos diferentes. En el etanol, el oxígeno se enlaza a un carbono y a un hidrógeno. En el dimetil éter está unido a dos carbonos. Se trata de isómeros estructurales puesto que los átomos están unidos de forma distinta en ambas moléculas. Al pertenecer a diferentes grupos funcionales (alcohol y éter) se les clasifica como isómeros de función.
Pentano y 2-Metilbutano son isómeros se cadena, ambos de fórmula C5H12. El pentano es un alcano con cadena lineal mientras que el 2-Metilbutano presenta una ramificación.

De nuevo obsérvese como los átomos están unidos de forma distinta en ambas moléculas.
El 2-Pentanol y el 3-Pentanol son isómeros de posición. El grupo hidroxilo ocupa distinta posición en cada molécula.

En los estereoisómeros los átomos están conectados de igual manera en ambas moléculas. La diferencia radica en la distinta orientación espacial de los átomos o grupos de átomos. Los estereoisómeros se clasifican en isómeros geométricos (cis-trans), enantiómeros y diastereoisómeros.
 (5)
(5)

Solamente existen dos formas de unir los átomos que generan compuestos diferentes. En el etanol, el oxígeno se enlaza a un carbono y a un hidrógeno. En el dimetil éter está unido a dos carbonos. Se trata de isómeros estructurales puesto que los átomos están unidos de forma distinta en ambas moléculas. Al pertenecer a diferentes grupos funcionales (alcohol y éter) se les clasifica como isómeros de función.
Pentano y 2-Metilbutano son isómeros se cadena, ambos de fórmula C5H12. El pentano es un alcano con cadena lineal mientras que el 2-Metilbutano presenta una ramificación.

De nuevo obsérvese como los átomos están unidos de forma distinta en ambas moléculas.
El 2-Pentanol y el 3-Pentanol son isómeros de posición. El grupo hidroxilo ocupa distinta posición en cada molécula.

En los estereoisómeros los átomos están conectados de igual manera en ambas moléculas. La diferencia radica en la distinta orientación espacial de los átomos o grupos de átomos. Los estereoisómeros se clasifican en isómeros geométricos (cis-trans), enantiómeros y diastereoisómeros.
 (5)
(5) Enlaces quimicos
Tipos de enlaces químicos
Los átomos se unen entre sí para formar moléculas mediante fuerzas de enlace. Los tipos fundamentales de enlace son el iónico, el covalente y el metálico. A continuación se describen cada uno de los tipos de enlace y sus características principales.
Enlace iónico
El enlace iónico consiste en la atracción electrostática entre átomos con cargas eléctricas de signo contrario. Este tipo de enlace se establece entre átomos de elementos poco electronegativos con los de elementos muy electronegativos. Es necesario que uno de los elementos pueda ganar electrones y el otro perderlo, y como se ha dicho anteriormente este tipo de enlace se suele producir entre un no metal (electronegativo) y un metal (electropositivo).
Un ejemplo de sustancia con enlace iónico es el cloruro sódico. En su formación tiene lugar la transferencia de un electrón del átomo de sodio al átomo de cloro. Las configuraciones electrónicas de estos elementos después del proceso de ionización son muy importantes, ya que lo dos han conseguido la configuración externa correspondiente a los gases nobles, ganando los átomos en estabilidad. Se produce una transferencia electrónica, cuyo déficit se cubre sobradamente con la energía que se libera al agruparse los iones formados en una red cristalina que, en el caso del cloruro sódico, es una red cúbica en la que en los vértices del paralelepípedo fundamental alternan iones Cl- y Na+. De esta forma cada ion Cl- queda rodeado de seis iones Na+ y recíprocamente. Se llama índice de coordinación al número de iones de signo contrario que rodean a uno determinado en una red cristalina. En el caso del NaCl, el índice de coordinación es 6 para ambos
Propiedades de los compuestos iónicos
Las sustancias iónicas están constituidas por iones ordenados en el retículo cristalino; las fuerzas que mantienen esta ordenación son fuerzas de Coulomb, muy intensas. Esto hace que las sustancias iónicas sean sólidos cristalinos con puntos de fusión elevados. En efecto, para fundir un cristal iónico hay que deshacer la red cristalina, separar los iones. El aporte de energía necesario para la fusión, en forma de energía térmica, ha de igualar al de energía reticular, que es la energía desprendida en la formación de un mol de compuesto iónico sólido a partir de los correspondientes iones en estado gaseoso. Esto hace que haya una relación entre energía reticular y punto de fusión, siendo éste tanto más elevado cuanto mayor es el valor de aquella.
Por otra parte, la aparición de fuerzas repulsivas muy intensas cuando dos iones se aproximan a distancias inferiores a la distancia reticular (distancia en la que quedan en la red dos iones de signo contrario), hace que los cristales iónicos sean muy poco compresibles. Hay sustancias cuyas moléculas, si bien son eléctricamente neutras, mantienen una separación de cargas. Esto se debe a que no hay coincidencia entre el centro de gravedad de las cargas positivas y el de las negativas: la molécula es un dipolo, es decir, un conjunto de dos cargas iguales en valor absoluto pero de distinto signo, separadas a una cierta distancia. Los dipolos se caracterizan por su momento; producto del valor absoluto de una de las cargas por la distancia que las separa. Un de estas sustancias polares es, por ejemplo el agua.
Cuando un compuesto iónico se introduce en un disolvente polar, los iones de la superficie de cristal provocan a su alrededor una orientación de las moléculas dipolares, que enfrentan hacia cada ion sus extremos con carga opuesta a la del mismo. En este proceso de orientación se libera una energía que, si supera a la energía reticular, arranca al ion de la red. Una vez arrancado, el ion se rodea de moléculas de disolvente: queda solvatado. Las moléculas de disolvente alrededor de los iones se comportan como capas protectoras que impiden la reagrupación de los mismos. Todo esto hace que, en general, los compuestos iónicos sean solubles en disolventes polares, aunque dependiendo siempre la solubilidad del valor de la energía reticular y del momento dipolar del disolvente. Así, un compuesto como el NaCl, es muy soluble en disolventes como el agua, y un compuesto como el sulfato de bario, con alta energía reticular, no es soluble en los disolventes de momento dipolar muy elevado.
Enlace covalente
Lewis expuso la teoría de que todos los elementos tienen tendencia a conseguir configuración electrónica de gas noble (8 electrones en la última capa). Elementos situados a la derecha de la tabla periódica ( no metales ) consiguen dicha configuración por captura de electrones; elementos situados a la izquierda y en el centro de la tabla ( metales ), la consiguen por pérdida de electrones. De esta forma la combinación de un metal con un no metal se hace por enlace iónico; pero la combinación de no metales entre sí no puede tener lugar mediante este proceso de transferencia de electrones; por lo que Lewis supuso que debían compartirlos.
Es posible también la formación de enlaces múltiples, o sea, la compartición de más de un par de electrones por una pareja de átomos. En otros casos, el par compartido es aportado por sólo uno de los átomos, formándose entonces un enlace que se llama coordinado o dativo. Se han encontrado compuestos covalentes en donde no se cumple la regla. Por ejemplo, en BCl3, el átomo de boro tiene seis electrones en la última capa, y en SF6, el átomo de azufre consigue hasta doce electrones. Esto hace que actualmente se piense que lo característico del enlace covalente es la formación de pares electrónicos compartidos, independientemente de su número.
Fuerzas intermoleculares
A diferencia que sucede con los compuestos iónicos, en las sustancias covalentes existen moléculas individualizadas. Entre estas moléculas se dan fuerzas de cohesión o de Van der Waals, que debido a su debilidad, no pueden considerarse ya como fuerzas de enlace. Hay varios tipos de interacciones: Fuerzas de orientación (aparecen entre moléculas con momento dipolar diferente), fuerzas de inducción (ion o dipolo permanente producen en una molécula no polar una separación de cargas por el fenómeno de inducción electrostática) y fuerzas de dispersión (aparecen en tres moléculas no polares).
Propiedades de los compuestos covalentes
Las fuerzas de Van der Waals pueden llegar a mantener ordenaciones cristalinas, pero los puntos de fusión de las sustancias covalentes son siempre bajos, ya que la agitación térmica domina, ya a temperaturas bajas, sobre las débiles fuerzas de cohesión. La mayor parte de las sustancias covalentes, a temperatura ambiente, son gases o líquidos de punto de ebullición bajo (por ejemplo el agua). En cuanto a la solubilidad, puede decirse que, en general, las sustancias covalentes son solubles en disolventes no polares y no lo son en disolventes polares. Se conocen algunos sólidos covalentes prácticamente infusibles e insolubles, que son excepción al comportamiento general descrito. Un ejemplo de ellos es el diamante. La gran estabilidad de estas redes cristalinas se debe a que los átomos que las forman están unidos entre sí mediante enlaces covalentes. Para deshacer la red es necesario romper estos enlaces, los cual consume enormes cantidades de energía
Electrovalencia y covalencia
Teniendo presenta las teorías de los enlaces iónicos y covalentes, es posible deducir la valencia de un elemento cualquiera a partir de su configuración electrónica.
- La electrovalencia, valencia en la formación de compuestos iónicos, es el número de electrones que el átomo tiene que ganar o perder para conseguir la configuración de los gases nobles.
- La covalencia, número de enlaces covalentes que puede formar un átomo, es el número de electrones desapareados que tiene dicho átomo. Hay que tener presente que un átomo puede desaparecer sus electrones al máximo siempre que para ello no haya de pasar ningún electrón a un nivel energético superior.
ENLACE METÁLICO
Los elementos metálicos sin combinar forman redes cristalinas con elevado índice de coordinación. Hay tres tipos de red cristalina metálica: cúbica centrada en las caras, con coordinación doce; cúbica centrada en el cuerpo, con coordinación ocho, y hexagonal compacta, con coordinación doce. Sin embargo, el número de electrones de valencia de cualquier átomo metálico es pequeño, en todo caso inferior al número de átomos que rodean a un dado, por lo cual no es posible suponer el establecimiento de tantos enlaces covalentes.
En el enlace metálico, los átomos se transforman en iones y electrones, en lugar de pasar a un átomo adyacente, se desplazan alrededor de muchos átomos. Intuitivamente, la red cristalina metálica puede considerarse formada por una serie de átomos alrededor de los cuales los electrones sueltos forman una nube que mantiene unido al conjunto.
POLARIDAD DE LOS ENLACES
En el caso de moléculas heteronucleares, uno de los átomos tendrá mayor electronegatividad que el otro y, en consecuencia, atraerá mas fuertemente hacia sí al par electrónico compartido. El resultado es un desplazamiento de la carga negativa hacia el átomo más electronegativo, quedando entonces el otro con un ligero exceso de carga positiva. Por ejemplo, en la molécula de HCl la mayor electronegatividad del cloro hace que sobre éste aparezca una fracción de carga negativa, mientras que sobre el hidrógeno aparece una positiva de igual valor absoluto. Resulta así una molécula polar, con un enlace intermedio entre el covalente y el iónico.(6)






 (7)
(7) Carga formal
Al representar una estructura de Lewis estamos describiendo la forma en que los electrones se distribuyen en una molécula dada. Sin embargo, en algunos casos es posible construir varias estructuras de Lewis para una misma especie, las cuales cumplen todos los requisitos aprendidos previamente. Veamos como ejemplo el CO2. Al calcular el número de enlaces que presenta esta molécula, obtendremos 4. Por tanto, podemos representar su estructura de Lewis de la siguiente forma:
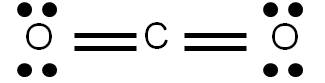
Hemos hecho lo más lógico: si hay que unir dos átomos por medio de cuatro enlaces, pues cada átomo se une al central por medio de un doble enlace. Sin embargo, la siguiente estructura también cumple con los requisitos vistos anteriormente:
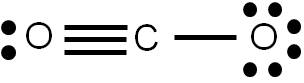
Vemos que hay cuatro enlaces covalentes, y cada átomo tiene el octeto completo. ¿Cuál de las dos estructuras es más razonable?
El concepto de carga formal nos ayudará a decidir cuál estructura es más correcta (nótese el término “más”: ambas estructuras son correctas, pero una de ellas es más estable que la otra). La carga formal nos representa la carga eléctrica que posee un átomo en una determinada molécula.
La carga formal de un determinado átomo se calcula de la siguiente forma:
CARGA FORMAL = [N° electrones de valencia] – [N° electrones no enlazados] – [N° de enlaces que tiene el átomo]
Es importante notar que debemos calcular la carga formal de TODOS los átomos que conforman una molécula (o ión) y que la suma de cargas formales debe ser igual a la carga eléctrica de la especie en estudio (si es una molécula neutra, debe ser cero; si es un ión, debe coincidir con la carga de éste).
La ESTRUCTURA MÁS ESTABLE será aquella que:
1. Tenga a sus átomos con cargas formales igual a cero.
2. Tenga a sus átomos con cargas formales similares y más cercanas a cero.
3. Tenga a los átomos más electronegativos soportando las cargas negativas.
| Ejemplo 3.6. Apliquemos el criterio de carga formal para la molécula de CO2. |
En este caso tenemos que unir dos átomos al átomo central utilizando cuatro enlaces. Podemos tener dos estructuras posibles: la estructura 1 y la estructura 2. Para cada estructura, calculamos las cargas formales de cada átomo:
Estructura 1
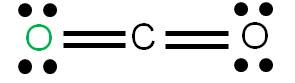

Estructura 2
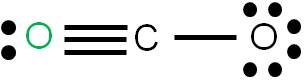

Vemos que en ambos casos, la suma de cargas formales coincide con la carga del compuesto: cero (se trata de una molécula neutra). Según los criterios para determinar cuál es más estable, observamos que la estructura más estable es la 1, porque tiene a todos sus átomos con carga formal cero. (8)
Momento dipolo
El momento dipolar como lo dice la palabra es cuando en una molécula hay átomos de distinta electronegatividad entonces hay un átomo que atrae más los electrones que el otro. El átomo que los atrae más se genera en su zona una densidad de carga negativa y en el otro átomo una positiva. Entonces aparece lo que es el momento dipolar, la separación de una carga electrica.
Fisicamente es el valor de la carga por la distancia y se suele medir en Debye. Un ejemplo, el agua, el oxígeno tiene una densidad negativa y los H una positiva por eso es una molécula polar. El etano (CH3CH3) presenta un momento dipolar mucho más bajo porque los C e H tienen muy similar electronefatividad.
El CO2 dioxido de carbono tiene dipolaridad 0, pero no por la diferencia de electronegatividad entre átomos sino que la molécula es lineal entonces la carga que atrae el O por un lado se compensa con la que atrae el otro oxigeno.(9)
Fisicamente es el valor de la carga por la distancia y se suele medir en Debye. Un ejemplo, el agua, el oxígeno tiene una densidad negativa y los H una positiva por eso es una molécula polar. El etano (CH3CH3) presenta un momento dipolar mucho más bajo porque los C e H tienen muy similar electronefatividad.
El CO2 dioxido de carbono tiene dipolaridad 0, pero no por la diferencia de electronegatividad entre átomos sino que la molécula es lineal entonces la carga que atrae el O por un lado se compensa con la que atrae el otro oxigeno.(9)
Grupos funcionales: alcohol, éter, aldehído, cetona, ácidos carboxílicos, éster, aminas, amidas y compuestos halogenados.
GRUPO FUNCIONAL: Es el grupo de átomos que caracterizan a una función química y que tienen propiedades características bien definidas. Ejemplo: el sabor ácido que tienen el limón y el vinagre se debe a la presencia en la estructura del grupo carboxilo -COOH.
Grupos funcionales y nomenclatura.
GRUPO FUNCIONAL: Es el grupo de átomos que caracterizan a una función química y que tienen propiedades características bien definidas. Ejemplo: el sabor ácido que tienen el limón y el vinagre se debe a la presencia en la estructura del grupo carboxilo -COOH.
Grupos funcionales y nomenclatura.
| COMPUESTO | GRUPO FUNCIONAL |
| Alcohol | Radical-OH |
| Ácido | Radical- H (Capacidad de donar protones) |
| Carboxilo | Radical-COOH |
| Aldehído | Radical-CO-Radical (En carbono terminal) |
| Cetona | Radical-COH (En carbono intermedio) |
| Amina | 1,2 o 3 Radicales- NH3,2 o 1 |
| Éter Compuestos Halogenados | Radical-O-Radical, Halógeno-Carbono (Cloro, bromo, flúor) |
| Éster | O ll R1 - C - O - R2 |
| Amida | O ll R1 - C - NH2 (10) |
Nomenclatura
Alcoholes: Se sustituye la o del nombre del abano por ol, que es la terminación característica de los alcoholes. Por ejemplo: Metanol.
Ácidos carboxílicos: Se le añade la terminación ico al nombre del alcano, o bien se suprime la o al final del alcano y se añade la terminación oico.
Aldehído: La terminación para los aldehídos es al. Se suprime la o final del alcano correspondiente y se añade al.
Cetona: La nomenclatura oficial sustituye la o final de los alcanos por a terminación ona, si es necesario se indica con número la posición del grupo funcional (grupo carbonilo).
Amina: Se consideran como aminoalcanos, se dice el nombre o nombres de los radicales alquílicos por orden de complejidad y luego la palabra. Por ejemplo: metil, etil amina.
Amida: Se suprimen la palabra ácido y la terminación óico del ácido carboxílico y se sustituye por la palabra amida.
Éter: Se utiliza la palabra oxi interpuesta entre los nombres de los dos radicales. Por ejemplo: CH 3-O-CH3 Metil - oxi - Metil.
Éster: Para nombrar los ésteres se suprime la palabra ácido, se cambia la terminación ico (del ácido carboxílico) por ato y se da el nombre del grupo alquilo o arilo derivado del alcohol.
Compuestos halogenados: Se dice el nombre del halógeno y su posición (cuando sea necesaria) y luego el nombre del hidrocarburo, o bien se dice el nombre del halógeno terminado en uro después la palabra 'de" y posteriormente el nombre del alcano terminado en ilo. Por ejemplo: CH 3- Cl
Nombre 1. Cloro metano.
Nombre 2. Cloruro de metilo.
Existen diversas moléculas cuyos electrones no parecen estar localizados en posiciones fijas (dadas por las estructuras de Lewis) sino dispuestos en diferentes posiciones. La teoría de la resonancia explica esto suponiendo que dichas moléculas son un compuesto intermedio entre una serie de estructuras moleculares llamadas formas resonantes. Cada una de ellas, por sí misma, no existe, existe el conjunto llamado híbrido de resonancia.
Por ejemplo, los electrones en el ion acetato (CH3CO2-) pueden considerarse como localizados en dos diferentes disposiciones:
Para ver el grafico seleccione la opción "Descargar" del menú superior
El híbrido de resonancia posee una menor energía (y por tanto es más estable) que cada una de las formas resonantes.
Las distintas formas canónicas o resonantes deben tener el mismo número y la misma clase de núcleos de átomos y el mismo número de electrones. La diferencia entre unas formas canónicas y otras se encuentra exclusivamente en la posición de los electrones.
Para que exista resonancia deben existir al menos dos formas resonantes que tengan energía similar si no la molécula perfectamente representada por la de menor energía que sería la predominante.
Cuanto mayor sea el número de formas resonantes la molécula será más estable.
Toda molécula que sólo posea enlaces simples no tiene formas resonantes. Las moléculas con enlaces múltiples pueden tener formas resonantes o no.
La resonancia estabiliza las moléculas e iones, lo cual puede explicar diversas tendencias de las reacciones químicas. De dichas tendencias se induce lo siguiente:
- Si un reactivo (material de partida) está estabilizado por resonancia, las reacciones químicas de esta molécula estarán menos favorecidas que en ausencia de resonancia.
- Si un producto (material resultante) está estabilizado por resonancia, las reacciones de las que se obtiene estarán más favorecidas.
Acidos y bases.
Según la Teoría de Bronsted-Lowry:
ÁCIDO es todo compuesto capaz de ceder un protón.
BASE es todo compuesto capaz de aceptar un protón.
Según la Teoría de Lewis:
ÁCIDO es toda sustancia capaz de aceptar un par de electrones.
BASE es toda sustancia capaz de ceder un par de electrones.
Aunque la Teoría de Lewis parece diferente, es coherente con otras teorías. La teoría de Bronsted-Lowry se refiere al ion H+. La definición de Lewis se refiere a los pares de electrones (que conllevan una carga negativa). En la teoría de Bronsted-Lowry es el protón H (H+) el que se mueve. En la teoría de Lewis, los electrones forman enlaces, que "tiran" de los átomos para llevarlos a sus nuevos posiciones.
Ácido | Base | |
Bronsted-Lowry | Donante de H+ | Receptor de H+ |
Lewis | Receptor de e- | Donante de e- (11) |
Bibliografía:
 + Energía
+ Energía 